新聞
呂愛平教授與張戈教授率領的研究團隊發現治療骨關節炎的新靶點
2021年4月30日
骨關節炎是最為常見的退化性關節病,影響全球數以百萬計人士,可造成受累關節持續疼痛、變形,甚至殘障。該病的主要病理變化為關節軟骨基質的持續退化、軟骨下骨的重塑異常與關節骨質增生(骨刺)。目前尚未有能有效預防或延緩該病的藥物。
由學院院長兼黃英豪博士中醫藥教授呂愛平教授與副院長(研究)張戈教授領導的研究發現:由軟骨下骨的破骨細胞衍生的小分子核糖核酸(miRNA)以外泌體形式釋放到軟骨細胞,可導致軟骨對基質退變、血管新生和神經支配的抵抗能力降低,從而促進骨關節炎的發展。相關研究結果已發表在國際科學期刊《Nature Aging》(https://www.nature.com/articles/s43587-021-00050-6)。
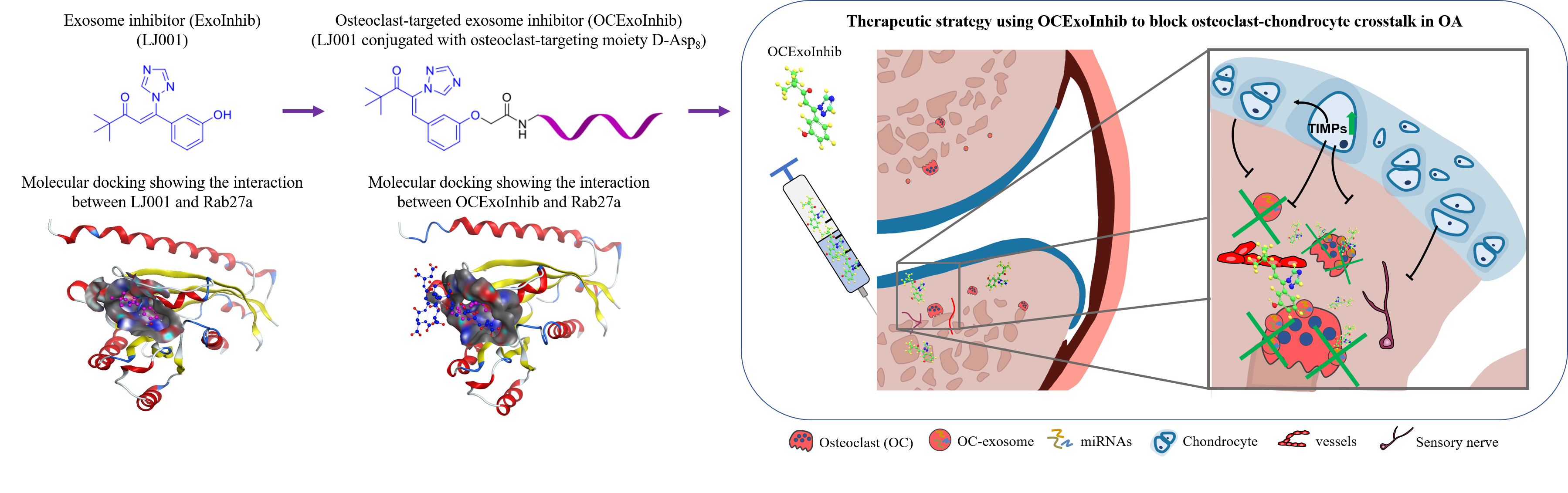
出乎團隊意料之外的是,當骨關節炎小鼠模型中參與調控破骨細胞外泌體分泌的細胞內蛋白Rab27a被抑制後,關節軟骨對基質退變、血管新生和神經支配的抵抗力得以恢復,小鼠的關節軟骨退變和疼痛症狀得到顯著改善。此項發現促使團隊進一步評估靶向抑制破骨細胞外泌體分泌對治療骨關節炎的潛在效用。
團隊基於早前報導的Rab27a蛋白小分子抑制劑的骨架以及分子對接技術的藥物設計,預測出該小分子抑制劑中可進行修飾的官能團,通過設計高效的合成路線和綠色的合成方法構建出一個Rab27a蛋白的小分子抑制劑化合物庫,並經過體外細胞實驗篩選出能夠安全、高效地抑制Rab27a蛋白的小分子抑制劑LJ001。
教學科研部助理教授劉進博士是團隊的核心成員,他指出:「若要把我們的研究成果應用到臨床上,在施予外泌體抑制劑作為藥物治療前,務必確保不會對非破骨細胞的外泌體分泌構成影響。外泌體乃新近發現的一種獨特細胞間通訊方式,對調解身體機能至關重要。」團隊於是採用前期開發的靶向破骨細胞寡肽適配子Asp8,再運用實驗室內成熟的適配子—小分子藥物偶聯技術,合成了一個具有破骨細胞靶向性且對外泌體分泌具有抑製作用的破骨細胞適配子—藥物偶合物(Asp8-LJ001)。團隊進一步在骨關節炎小鼠模型中,驗證出該破骨細胞適配子—藥物偶合物具有顯著延緩骨關節炎發展的治療效果。總括而言,此項研究為開發治療骨關節炎的創新藥物帶來嶄新策略。
其他團隊成員包括研究助理吳曉昊和黨蕾博士、博士研究生張華睿和鍾傳新,以及成都中醫藥大學藥學院魯軍教授和南方醫科大學附屬第三醫院關節外科黃廣鑫博士。